Se llama hematocrito al volumen que ocupan los hematíes con respecto al volumen total de sangre. Se expresa en %, es decir, cm3 o ml de hematíes que hay en 100 cm3 de sangre.
Al centrifugar sangre total las partículas pesadas que se depositan en el fondo son los hematíes, sobre estos se depositan partículas más ligeras como los leucocitos y las plaquetas y por último en la parte superior del tubo se encuentra el plasma. De esta manera, se originan unas bandas de sedimentación observables a simple vista. La lectura debe hacerse sobre la parte superior de los hematíes y evitar el resto de célula , sobre todo en caso de aumento de leucocitos y plaquetas.
MATERIAL
- CAPILAR DESECHABLE DE 7 CM DE LONGITUD Y 1 MM DE DIÁMETRO INTERNO CON HEPARINA.
- LANCETA
- CENTRIFUGA DE MICROHEMATOCRITO
- PLASTILINA
- GASAS
- LECTOR DE MICROHEMATOCRITO Y EN SU DEFECTO UNA REGLA MILIMETRADA
TÉCNICA
- Con la lanceta puncionar en un dedo, previamente desinfectado con alcohol y masajeando. Ponemos el tubo capilar en contacto con la sangre hasta que se llene por capilaridad 3/4 partes y despúes hacemos lo mismo con un 2º tubo y la misma sangre, ya que la determinación se realiza por duplicado. El tubo capilar utilizado será el que tenga la franja de color rojo, pues es el que contiene heparina y la necesitamos pues la sangre utilizada es capilar. Si la muestra que utilizamos es venosa el capilar será sin heparina.
- Taponar los capilares por el extremo más próximo a la sangre con plastilina.
- Colocar los dos tubos en posición opuesta en los surcos radiales del plato de la centrífuga, de forma que el estremo sellado con plastilina quede en la parte exterior.
- Cerramos la tapa, ajustamos la velocidad a 15.000 r.p.m durante 5'.

- La capa de color gris que aparece ente los hematíes y el plasma está formada por leucocitos y plaquetas. La aparición de un plasma de color naranja o verdoso sugiere un aumento de la bilirrubina en sangre, mientras que si el color es rojo sugiere la presencia de hemoglobina.
- Realizar la lectura mediante lector de microhematocrito y con una regla milimetrada.
MEDIANTE LECTOR DE HEMATOCRITO
Situar el hematocrito en la ranura, con la columna de eritrocitos hacia el punto rojo.
Girar el disco central hasta hacer coincidir:
- La línea más alejada del punto rojo con el final de la columna de plasma.
- La línea más cercana del punto rojo con el inicio de la columna de eritrocitos.
- La línea central, con la interfase de separación presente entre el plasma y los eritrocitos.
- Leer en la escala inferior, el valor del hematocrito.
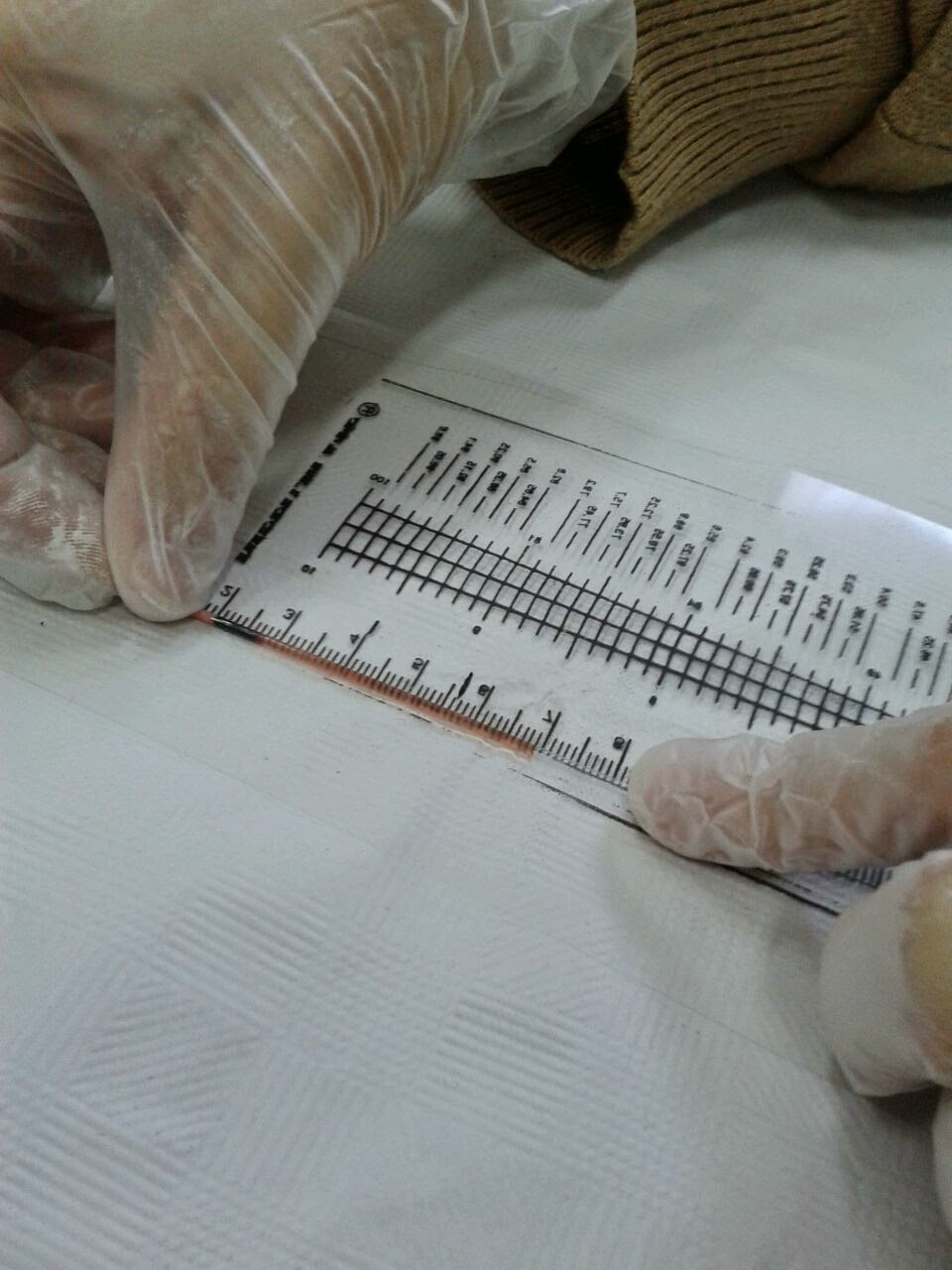 MEDIANTE UNA REGLA MILIMETRADA
MEDIANTE UNA REGLA MILIMETRADAColocar el capilar del hematocrito al lado de la regla y medir los mm de eritrocitos, medir lo que ocupan en total los eritrocitos y el plasma.
Calcular el porcentaje que le corresponde a la columna de eritrocitos , mediante una regla de tres:
Hematocrito(%) = L2/L1 x 100
RESULTADOS
- Aspecto del plasma.
Al realizar todos los pasos establecidos anteriormente se observa una tono casi marrón del plasma debido a la muestra de sangre empleada ( sangre muy caducada)
- Medición con la regla.
Columna total 50 mm.
Columna eritrocitos 6 mm.
Hematocrito(%) = 6/50 x 100 = 12%
Como podemos observar el valor obtenido está muy por debajo de la media establecida debido a la sangre que hemos empleado por lo tanto este valor es normal teniéndo en cuenta el estado de ésta.













































